

제약·바이오 산업의 핵심 시스템에 대한 전문 밸리데이션 서비스
실험실 정보 관리 시스템
품질 관리 시스템
과학 데이터 관리 시스템
분석기기 제어 소프트웨어

15년 이상의 경험을 보유한 CSV 전문가들이 귀사의 시스템 특성을 정확히 분석하고, 최적의 밸리데이션 전략을 수립합니다.
제약·바이오 산업의 규제 환경에서 사용되는 모든 컴퓨터화 시스템에 대해
체계적이고 전문적인 밸리데이션 서비스를 제공합니다.
계획부터 실행, 문서화까지 완벽한 밸리데이션 지원
전략 수립부터 감사 대응까지
Gap Analysis
현재 시스템의 규제 준수 수준 진단 및 개선 로드맵 제시
밸리데이션 전략 수립
GAMP5 기반 시스템 분류 및 리스크 기반 접근법 설계
규제 감사 대응 지원
FDA, MFDS 등 규제 당국 감사 준비 및 현장 지원
SOP 개발 및 검토
시스템 운영을 위한 표준 운영 절차서 작성
검증을 위한 완벽한 문서 패키지
Installation Qualification (IQ)
시스템 설치 적격성 확인 프로토콜 및 보고서
Operational Qualification (OQ)
시스템 기능별 운영 적격성 테스트 스크립트
Performance Qualification (PQ)
실제 업무 환경에서의 성능 검증 시나리오
추적성 매트릭스 (RTM)
요구사항-테스트 케이스 간 추적 관리
ALCOA+ 원칙 기반 완전성 확보
감사 추적 (Audit Trail) 검증
모든 데이터 변경 이력의 완전성 및 정확성 확인
전자 서명 검증
21 CFR Part 11 요구사항 충족 여부 테스트
접근 권한 관리 검증
사용자별 역할 기반 접근 통제 테스트
백업 및 복구 테스트
데이터 손실 방지 체계 검증
모든 밸리데이션 문서는 규제 기관의 요구사항을 완벽히 충족하도록 작성되며, 감사 추적이 가능한 체계적인 관리 시스템을 통해 관리됩니다.
표준화된 템플릿
검증된 문서 템플릿으로 일관성 확보
버전 관리
문서 변경 이력의 완벽한 추적
감사 대응
규제 당국 요청 시 즉시 제공 가능

HPLC, GC, MS, UV-Vis 등 분석장비 제어 및 데이터 처리 소프트웨어에 대한 전문적인 밸리데이션 서비스를 제공합니다.
규제 감사에 완벽 대응하는 체계적 문서 체계
Validation Master Plan
User Requirements Specification
Functional Specification
위험 평가 및 관리
적격성 프로토콜 및 보고서
Validation Summary Report
시스템의 규모, 복잡도, GAMP 카테고리에 따라 필요한 문서를 선별하여 제공합니다. 모든 문서는 FDA, MFDS 감사 시 요구되는 형식과 내용을 완벽하게 충족합니다.
FDA가 요구하는 데이터 무결성 원칙을 완벽하게 충족
귀속 가능성
판독 가능성
동시 기록성
원본성
정확성
완전성
일관성
가용성
현재 시스템의 데이터 무결성 수준 평가 및 취약점 식별
ALCOA+ 각 원칙별 상세 테스트 시나리오 실행
발견사항 개선 및 데이터 무결성 보고서 작성
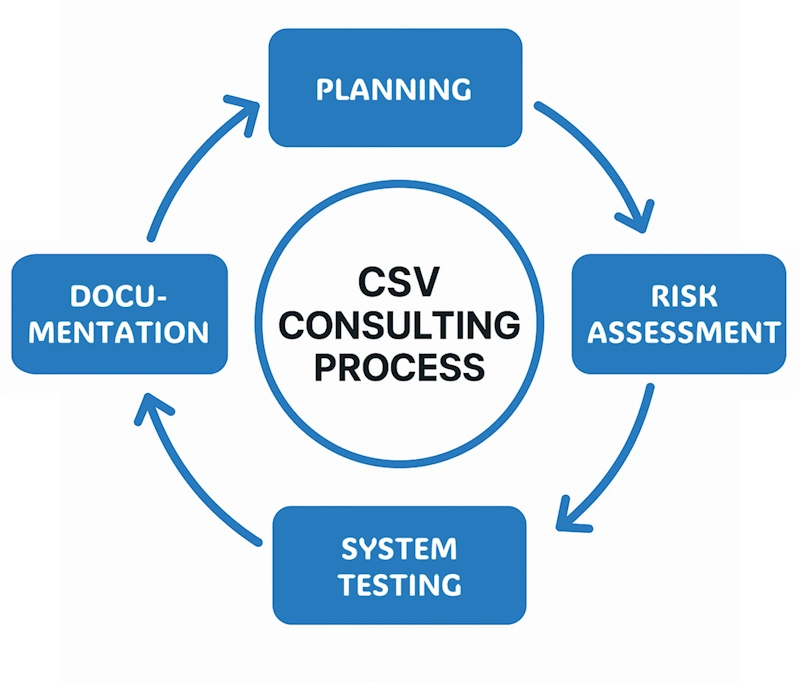
체계적인 CSV 컨설팅 프로세스: 계획 → 위험 평가 → 시스템 테스트 → 문서화
체계적이고 검증된 단계별 접근으로 성공적인 밸리데이션 보장
프로젝트 범위 정의 및 밸리데이션 전략 수립
주요 산출물
요구사항 정의 및 시스템 설계 문서 작성
주요 산출물
IQ/OQ/PQ 프로토콜 작성 및 실행
주요 산출물
검증 완료 및 시스템 운영 준비
주요 산출물
평균 3~4개월
시스템 규모, 복잡도, GAMP 카테고리에 따라 일정이 조정됩니다.
각 시스템 특성에 맞춘 전문적인 밸리데이션 경험
대형 제약사 품질관리 실험실
워크플로우 검증
시험 의뢰 → 샘플 접수 → 시험 수행 → 결과 검토 → 승인 프로세스
전자서명 검증
21 CFR Part 11 요구사항 충족 확인
인터페이스 검증
분석장비 → LIMS 자동 데이터 전송 정확성
바이오 의약품 제조사 QC 실험실
IQ: 설치 검증
소프트웨어 버전, 라이선스, 시스템 구성 확인
OQ: 기능 검증
메서드 작성, 시퀀스 실행, 적분, 보고서 생성
PQ: 성능 검증
실제 분석 메서드로 표준물질 반복 측정
감사 추적 검증
데이터 변경 이력 기록 및 조회 기능
중견 제약사 품질보증부
문서 생명주기 검증
작성 → 검토 → 승인 → 배포 → 폐기 프로세스
접근 권한 검증
역할 기반 권한 관리 및 분리
CAPA 워크플로우
일탈 발생 → 원인 조사 → 시정/예방 조치 → 효과 확인
연구개발 중심 바이오텍 기업
데이터 저장 검증
원시 데이터 무결성 보존 및 메타데이터 관리
백업/복구 검증
정기 백업 수행 및 복구 시나리오 테스트
검색 및 조회
메타데이터 기반 검색 기능 및 감사 대응
15년 이상의 경험과 전문성으로 신뢰할 수 있는 파트너
CSV에 대해 궁금하신 사항을 확인하세요
20년 경력의 전문가가 귀사의 시스템에 최적화된
밸리데이션 전략을 제시해 드립니다.
평일 09:00 - 18:00 | 전문 컨설턴트가 직접 상담해 드립니다.